铁对神经递质合成、髓鞘形成、DNA合成和线粒体功能等生理过程至关重要,深刻影响神经发育、认知和大脑结构。大脑对铁稳态进行精确调节,铁过量或铁缺乏的失调都可能导致大脑紊乱。
一些神经退行性疾病中,铁积累可能加速神经元细胞死亡,如阿尔茨海默病(AD)。帕金森症(PD)中,黑质通常含有过量的铁,可能会导致氧化应激和神经元损伤。此外,大脑铁缺乏与海马糖皮质激素受体信号变化相关,诱发抑郁症的发生。鉴于铁在大脑发育中的重要作用及其与多种大脑疾病的联系,探索脑铁积累的遗传因素可以深入了解大脑发育和疾病发生的潜在机制,从而设计更好的诊断和治疗策略。
2024年7月2日(当地时间),复旦大学附属华山医院、天桥脑科学研究院(Tiaoqiao and Chirssy Chen Institute,TCCI)研究员郁金泰、复旦大学类脑智能研究院研究员程炜和复旦大学青年研究员公维康合作,于期刊Nature Communications发表题为“Whole-exome sequencing identifies protein-coding variants associated with brain iron in 29,828 individuals”的论文。该研究对生物样本库的26,789名英国参与者的26个大脑区域的脑铁进行了外显子组范围的关联分析,通过定量磁化率成像技术进行测量。
研究发现了36个与脑铁相关的基因,其中29个以前从未报道过,其中16个可以在3,039名受试者的独立数据集中复制。FTH1和MLX等许多基因参与铁转运和体内平衡。一些基因虽然与脑铁无关,但与铁相关的脑部疾病有关,如帕金森症(STAB1, KCNA10)、阿尔茨海默症(SHANK1)和抑郁症(GFAP)。孟德尔随机化分析揭示了局部脑铁到脑部疾病的六种因果关系,如从海马体到抑郁症,从黑质到帕金森症。该研究增强了研究者对脑铁遗传基因的理解,并为脑部疾病提供了潜在的治疗靶点。

▷Gong, Weikang, et al. “Whole-exome sequencing identifies protein-coding variants associated with brain iron in 29,828 individuals.” Nature communications 15.1 (2024): 5540. https://doi.org/10.1038/s41467-024-49702-2
定量磁化率成像(QSM)是一种新兴技术,能够以高空间分辨率和灵敏度对脑铁水平进行非侵入性测量。QSM建立在磁化率加权磁共振成像(swMRI)的基础上,比其他swMRI衍生的测量(如T2*)更能反映表型和遗传上的组织铁含量,并对采集噪声具有更高的稳健性和可重复性。尸检研究证明脑铁水平与QSM之间存在高度正相关关系,脑铁在多个区域具有较高的遗传性,如壳核、黑质和苍白球。虽然全基因组关联研究(GWAS)发现了几个与脑铁相关的位点,但仍局限于几个大脑区域和常见的遗传变异(次要等位基因频率>1%)。
此外,GWAS鉴定的许多位点映射到基因组的非编码区域,给机制探索带来了挑战。针对上述限制,全外显子组测序(WES)可用于识别与脑铁相关的蛋白质编码变异,对多个大脑区域进行大规模的外显子组全关联分析可以揭示脑铁积累的复杂遗传结构,并突出铁相关脑部疾病的重要神经通路。
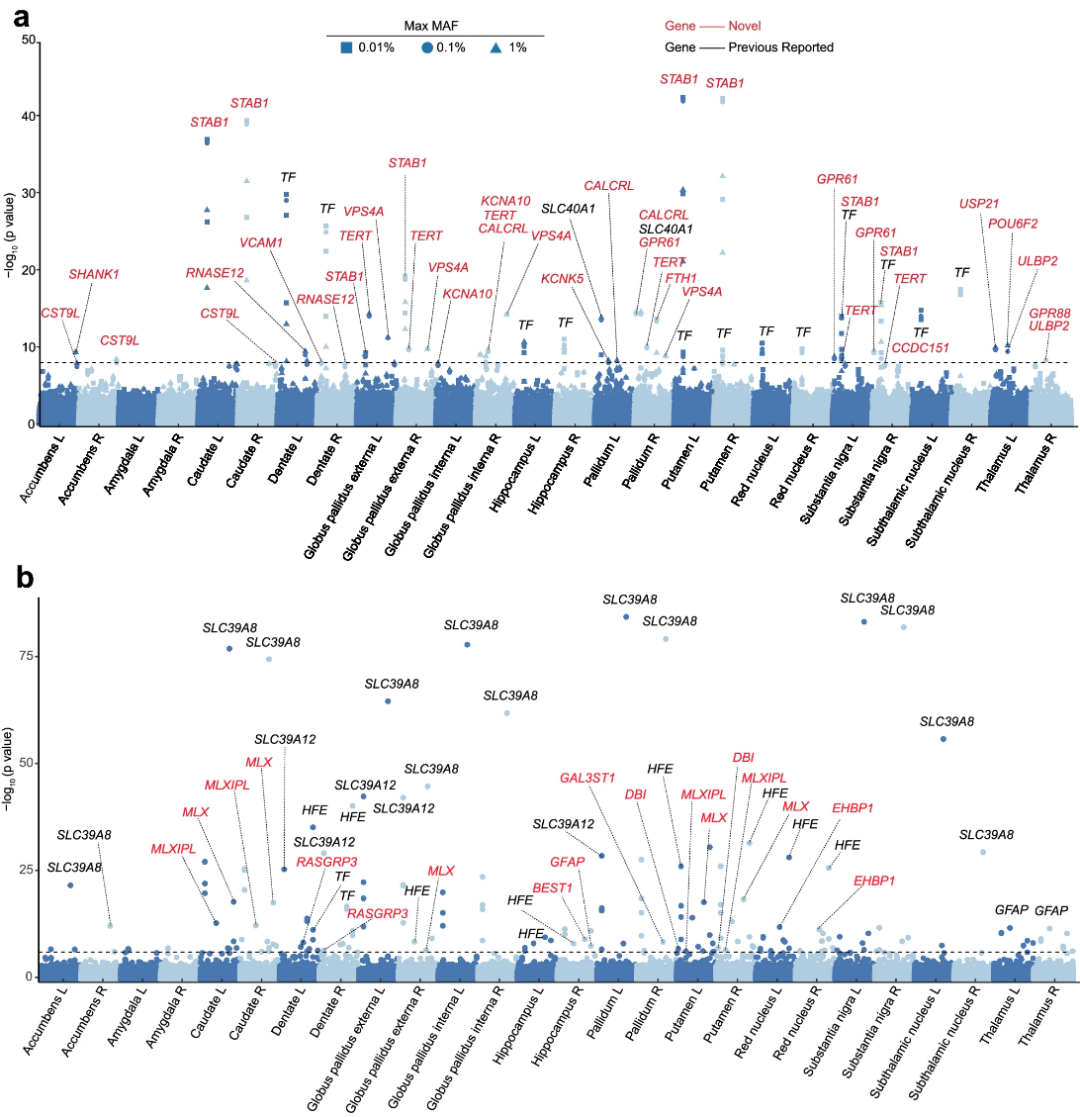
▷26个区域中罕见和常见蛋白质编码基因与脑铁的外显子组全关联分析。
该研究进行了迄今为止最广泛的脑铁积累全外显子组关联研究(EWAS)。利用英国生物样本库中26,789名受试者的遗传信息、脑成像和表型数据,系统地鉴定了与脑铁相关的蛋白质编码变异,并研究了铁相关基因与脑部疾病和表型之间的关系。
具体来说,该研究有四个主要目标:首先,确定与覆盖皮质下和小脑结构的多个大脑区域脑铁积累相关的罕见和常见基因;其次,探索已鉴定基因的生物学功能,如其富集的生物学途径;第三,探索脑铁相关基因与疾病之间的关系,包括区域脑铁积累是否与多种脑部疾病有因果关系;最后,使用全表型组关联研究(PheWAS)鉴定脑铁相关基因与一组系列表型变量的遗传关联。
