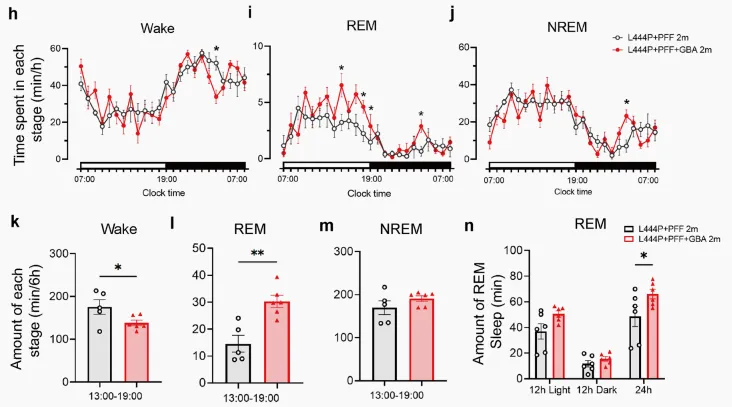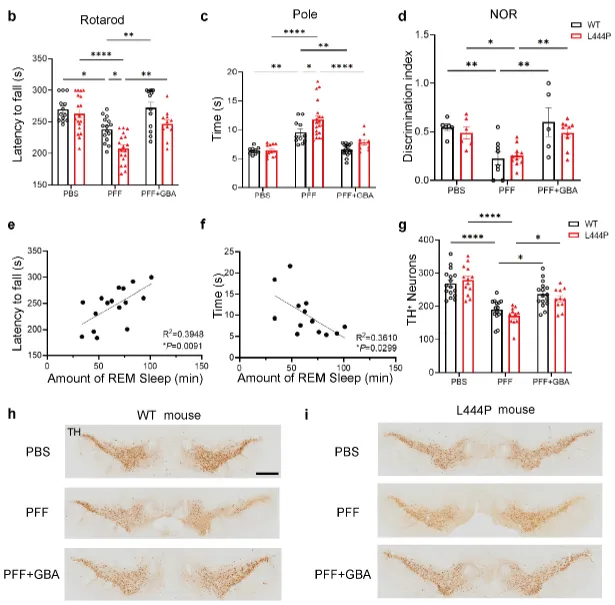
加州理工学院的研究人员量化了人类思维的速度:每秒10比特。然而,我们身体的感官系统以每秒一万亿比特的速度收集环境数据,这比我们的思维过程快了一亿倍。这项新研究为神经科学家开辟了重大的新探索方向,尤其是:为什么我们的思维只能一次专注于一件事,而感官系统却能同时处理数千个输入。
这项研究由Anne P.和Benjamin F. Biaggini生物科学教授Markus Meister领导的实验室完成,研究由研究生郑洁瑜主导。描述该研究的论文于12月17日发表在《神经元》(Neuron)期刊上。
这篇论文的标题为《The Unbearable Slowness of Being: Why do we live at 10 bits/s?》。研究经费由Simons Collaboration on the Global Brain和National Institutes of Health提供支持。Markus Meister是加州理工学院陈天桥雒芊芊神经科学研究院的教授。