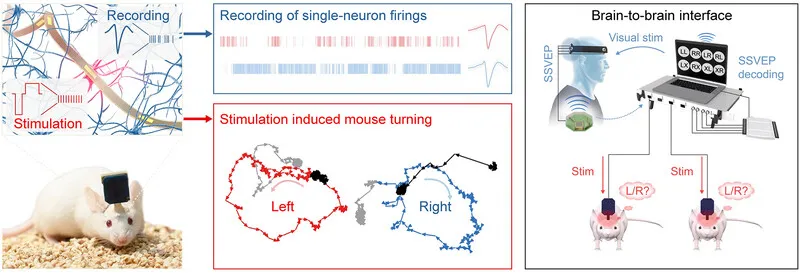
在血管疾病干预与康复领域,中国科学家迈出关键一步。10月14日,中国科学院上海微系统与信息技术研究所、中国科学院大学、复旦大学附属华山医院、脑虎科技、广东省智能科学与技术研究院、天桥脑科学研究院等联合研究团队在Nature Communications发表最新成果,报道了一种可生物黏附、可顺应血管形态的生物电子界面(BACE),可在活体中实现血管运动功能(vasomotoricity)的精准监测与神经电调控,为理解自主神经调节机制及干预血管功能障碍提供了全新工具。

▷ Xiner Wang, Weijian Fan, Yuxin Liu, Li Chen, Erda Zhou, Xiaoling Wei, Liuyang Sun, Bo Yu, Tiger H. Tao, Zhitao Zhou & Jinyun Tan. Bioadhesive and conformable bioelectronic interfaces for vasomotoricity monitoring and regulation. Nat Commun 16, 9103 (2025). https://doi.org/10.1038/s41467-025-64118-2
研究团队指出,自主神经系统通过电生理信号动态调节血管平滑肌收缩与舒张,以维持血流稳定。然而,现有临床影像工具难以捕捉这一电生理过程,尤其在支架植入等血管干预后,缺乏对血管运动功能障碍的直接检测手段。为此,团队设计出一种能长期贴合血管表面、在湿润环境下稳定工作的柔性生物电子界面。
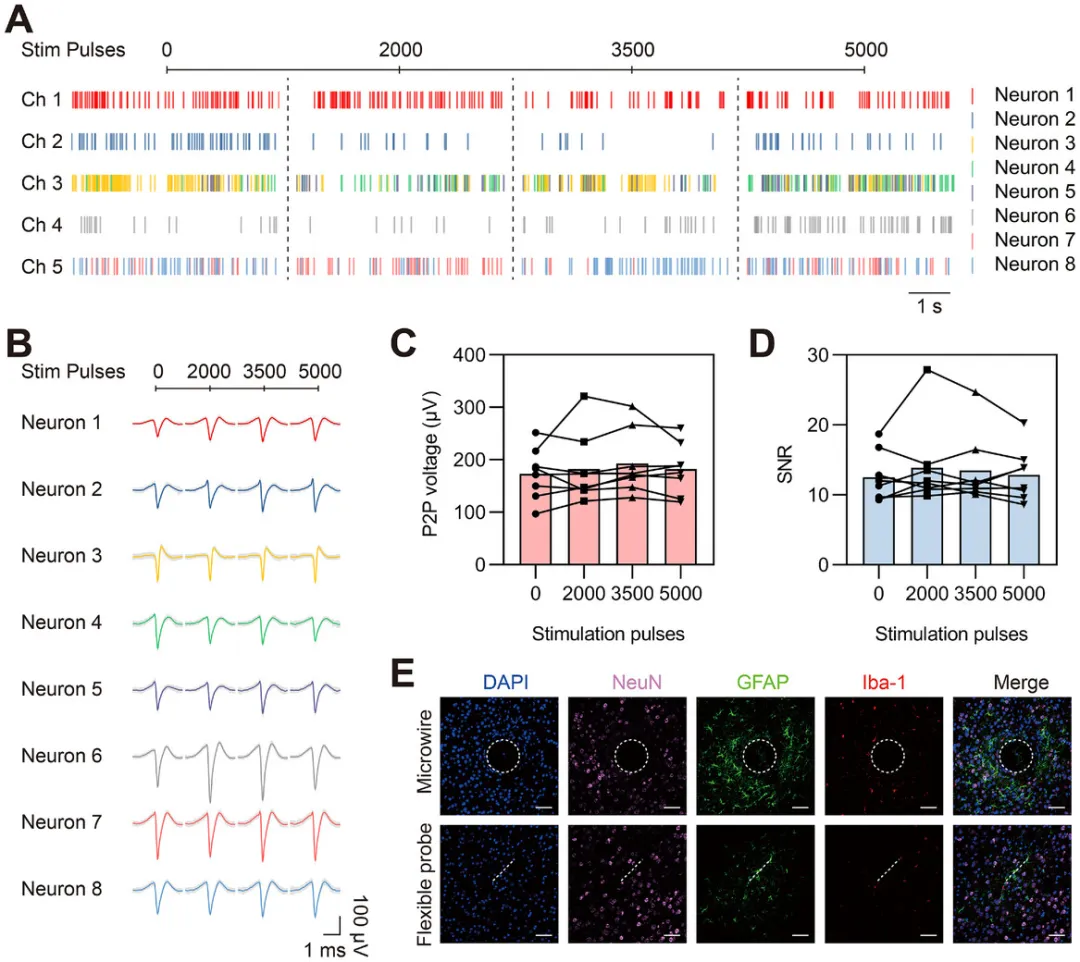
该装置以蚕丝蛋白/聚氨酯复合材料为黏附基底,结合PEDOT:PSS修饰的金电极与聚酰亚胺封装层,兼具高黏附力、低模量与高导电性。其在1kHz下的界面阻抗仅6.77 ± 2.13 kΩ,背景噪声低至2.63 ± 0.52 μV,可在活体条件下长达两个月稳定记录高保真电信号。实验表明,该材料在模拟血流环境中依旧保持黏附与电稳定性,展现优异的顺应性与生物兼容性。
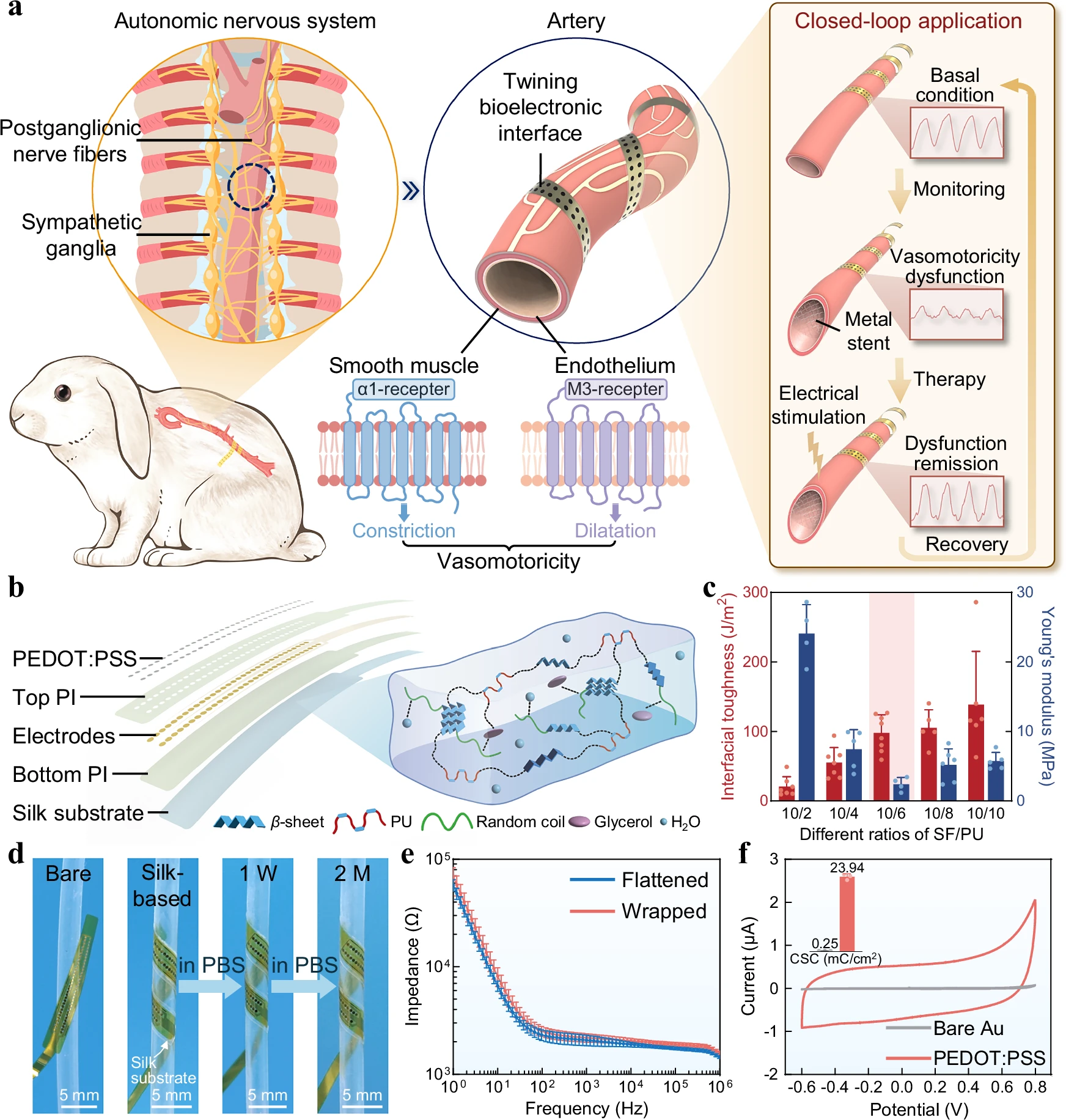
▷ BACE接口的概述与特征分析
在动物实验中,研究者通过外源性施加去甲肾上腺素和乙酰胆碱,成功记录到血管收缩与舒张状态下的电生理差异信号,并揭示其与药物剂量的相关性;同时,切断交感神经节后,电信号显著衰减,验证了该系统对自主神经调控的灵敏响应。
更为关键的是,团队将该系统应用于支架植入模型,实现了血管运动障碍的实时检测。研究发现,支架植入后血管远端电活动明显减弱,且与超声测得的血管硬度参数(β值)变化一致,证实BACE系统可准确评估血管功能损伤。
此外,研究还展示了系统的双向调控功能:通过在支架处施加300 μA电刺激,可显著恢复血管远端电信号强度与弹性,β值由18.83降至14.06,提示电调控可改善血管顺应性并延缓功能退化。这一闭环“监测—刺激—恢复”机制为未来血管疾病治疗提供了新路径。
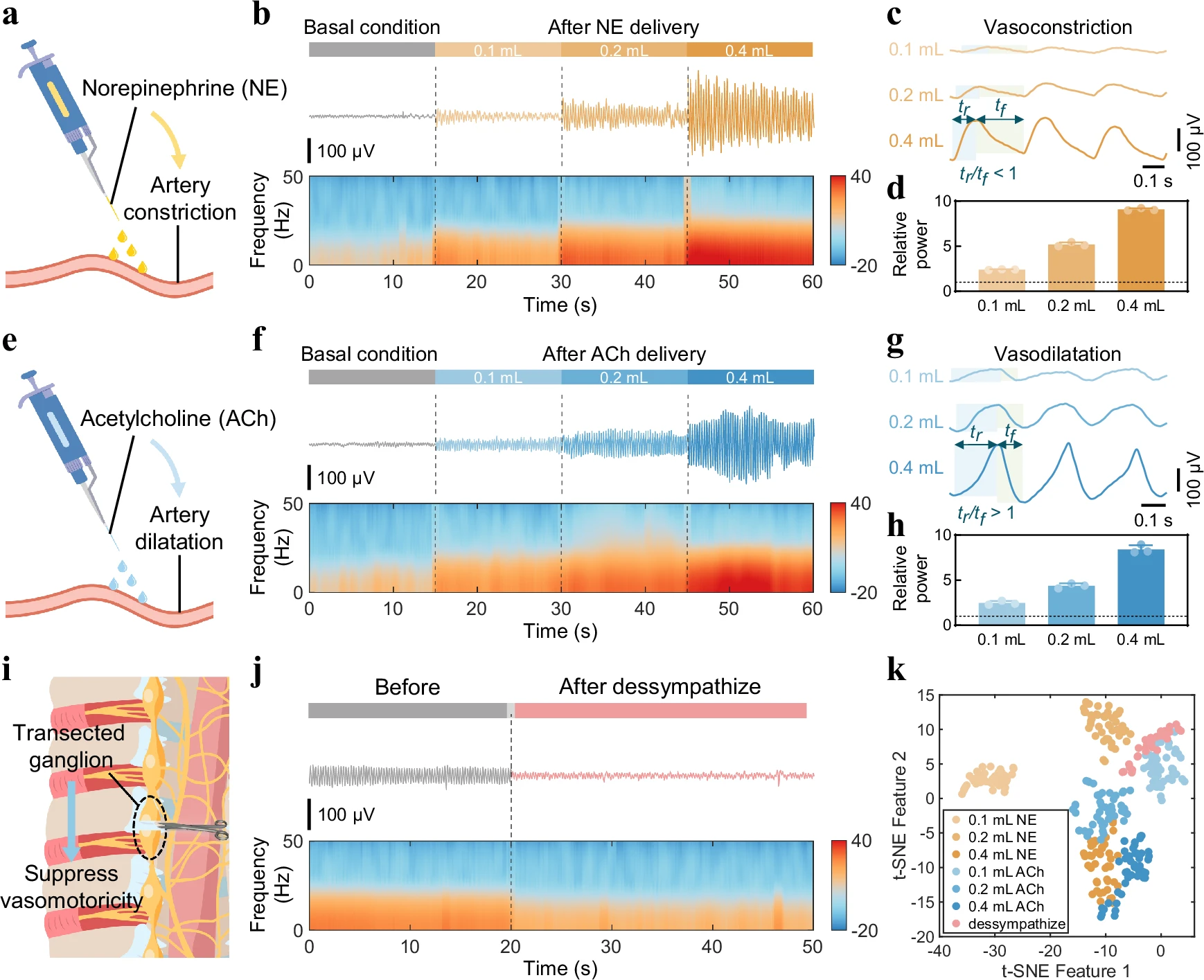
▷ 精确血管运动电生理记录评估
论文通讯作者、脑虎科技创始人、天桥脑科学研究院研究员陶虎指出,该研究“首次在血管体系中实现了高质量电生理监测与神经调控的统一,为血管功能障碍的精准诊疗开辟了新方向”。团队计划进一步开发无线化、长期植入版本,推动其在血管再狭窄、动脉硬化及动脉瘤等疾病中的临床转化应用。
该成果不仅揭示了血管运动电生理机制的新窗口,也展示了柔性生物电子学在血管医学中的巨大潜力,标志着智能化血管电调控技术的重要突破。












 朱航宇,复旦大学信息科学与工程学院博士生
朱航宇,复旦大学信息科学与工程学院博士生
 陈炜,悉尼大学生物医学工程学院院长,IEEE TBME副编辑,IEEE-JBHI、IEEE-TNSRE、IEEE-JTEHM副主编
陈炜,悉尼大学生物医学工程学院院长,IEEE TBME副编辑,IEEE-JBHI、IEEE-TNSRE、IEEE-JTEHM副主编 陈晨,复旦大学人类表型组研究院副研究员
陈晨,复旦大学人类表型组研究院副研究员





